
RESOLUÇÃO Nº 674, DE 06 DE MAIO DE 2022
Publicado no DOU em: 25/10/2022 | Edição: 203 | Seção: 01 | Página: 65
Dispõe sobre a tipificação da pesquisa e a tramitação dos protocolos de pesquisa no Sistema CEP/Conep.
O Presidente do Conselho Nacional de Saúde (CNS), no uso de suas competências regimentais e atribuições conferidas pelo Regimento Interno do CNS e garantidas pela Lei nº 8.080, de 19 de setembro de 1990; pela Lei nº 8.142, de 28 de dezembro de 1990; pela Lei Complementar nº 141, de 13 de janeiro de 2012; pelo Decreto nº 5.839, de 11 de julho de 2006; cumprindo as disposições da Constituição da República Federativa do Brasil de 1988 e da legislação brasileira correlata; e
Considerando a afirmação do Sistema Único de Saúde (SUS) como modelo de sistema universal de saúde instituído pela Constituição-Cidadã de 1988, que é direito de todos e dever do Estado, em seus princípios e diretrizes garantidores da universalidade, integralidade e equidade do acesso às ações e serviços públicos de saúde, incluindo a gestão descentralizada, hierarquizada, regionalizada e com a participação da comunidade;
Considerando que compete ao Plenário do CNS aprovar normas sobre ética em pesquisas envolvendo seres humanos e outras questões no campo da bioética e acompanhar sua implementação, segundo prevê o Art. 11, XIV do Regimento Interno do CNS;
Considerando a Resolução CNS nº 446, de 11 de agosto de 2011, que dispõe sobre as competências da Comissão Nacional de Ética em Pesquisa (CONEP/CNS/MS); e
Considerando que é atribuição do Presidente do Conselho Nacional de Saúde decidir, ad referendum, acerca de assuntos emergenciais, quando houver impossibilidade de consulta ao Plenário, submetendo o seu ato à deliberação do Plenário em reunião subsequente (Art. 13, inciso VI do Regimento Interno do CNS, aprovado pela Resolução CNS nº 407, de 12 de setembro de 2008).
Resolve ad referendum do Pleno do Conselho Nacional de Saúde
Aprovar as seguintes diretrizes referentes à tipificação da pesquisa e a tramitação dos protocolos de pesquisa no Sistema CEP/Conep.
Seção Única
Capítulo I
DAS DISPOSIÇÕES PRELIMINARES
Art. 1° Esta Resolução estabelece a tramitação dos protocolos de pesquisa científica envolvendo seres humanos, no Sistema CEP/Conep, de acordo com a tipificação da pesquisa e os fatores de modulação, na forma definida por esta Resolução.
Capítulo II
DOS TERMOS E DEFINIÇÕES
Art. 2° Para fins desta Resolução, os seguintes termos e definições são adotados:
I - Acervo: conjunto organizado de documentos, em formato físico ou eletrônico, que pode servir como fonte para a coleta de informações para a constituição de um banco de dados com finalidade de pesquisa científica;
II - Anonimização: utilização de meios técnicos razoáveis e disponíveis no momento do tratamento, por meio dos quais um dado perde a possibilidade de associação, direta ou indireta, a um indivíduo;
III - Coleta dirigida de dados: atividade com interação presencial ou em ambiente virtual, realizada com o propósito de gerar ou de coletar dados que serão analisados na pesquisa, incluindo entrevistas, aplicação de questionário e de escalas, preenchimento de formulários, realização de atividade com grupo focal, entre outros;
IV - Comitê de Ética em Pesquisa Acreditado: CEP que, além de credenciado no Sistema CEP/Conep, é certificado pela Conep para a análise de protocolos que tramitam na modalidade colegiada especial;
V - Comitê de Ética em Pesquisa Credenciado: CEP que atende às condições de funcionamento estabelecidas nas diretrizes do Sistema CEP/Conep, tem seu registro concedido pela Conep e pode atuar como CEP de instituição proponente, participante ou coparticipante;
VI - Dado pessoal: informação relacionada à pessoa natural identificada ou identificável;
VII - Delineamento do estudo: método adotado para alcançar os objetivos do estudo;
VIII - Dispositivo da área da saúde: equipamento, aparelho, material, artigo ou sistema aplicável na área da saúde que não utiliza o meio farmacológico, imunológico ou metabólico para realizar sua principal função, podendo, entretanto, ser auxiliado, em suas funções, por tais meios;
IX - Entrevista: interação presencial ou virtual, individual ou em grupo, na qual a coleta e a geração de dados têm como base um roteiro previamente elaborado ou uma pergunta disparadora;
X - Fármaco: substância química que é o princípio ativo do medicamento;
XI - Fatores de modulação: características do processo de consentimento, da confidencialidade e/ou dos métodos da pesquisa que possam modificar o tipo de tramitação do protocolo no Sistema CEP/Conep;
XII - Informações de acesso público: dados que podem ser utilizados na produção de pesquisa e na transmissão de conhecimento e que se encontram disponíveis, sem restrição ao acesso dos pesquisadores e dos cidadãos em geral, não estando sujeitos a limitações relacionadas à privacidade, à segurança ou ao controle de acesso. Essas informações podem estar processadas, ou não, e contidas em qualquer meio, suporte e formato, produzido ou gerido por órgãos públicos ou privados;
XIII - Informações de domínio público: dados, documentos ou obras que não são protegidos por direitos autorais;
XIV - Informações ou dados agregados: representam dados ou informações de um conjunto de pessoas ou de uma população e não permitem o seu detalhamento no âmbito individual;
XV - Intervenção no corpo: procedimento da pesquisa realizado no corpo humano, em sua dimensão física, podendo ter, ou não, caráter invasivo;
XVI - Material biológico humano: espécimes, amostras e alíquotas de material biológico original e seus componentes fracionados;
XVII - Medicamento: produto farmacêutico com finalidade profilática, diagnóstica ou terapêutica;
XVIII - Observação: procedimento da pesquisa em que as ações da vida cotidiana são observadas pelo pesquisador, com ou sem interação com o participante;
XIX - Observação participante: procedimento da pesquisa característico da área de Ciências Humanas e Sociais, em que o pesquisador tem contato direto (presencial ou virtual) com o participante, partilhando, na medida em que as circunstâncias permitam, as atividades, as ocasiões, os interesses e os afetos de um grupo de pessoas ou de uma comunidade, com o objetivo de obter informações sobre a realidade social em seu próprio contexto;
XX - Organismo geneticamente modificado: organismo cujo material genético tenha sido modificado por qualquer técnica de manipulação genética;
XXI - Organismo que representa alto risco à coletividade: organismo com alto risco de produzir agravo à saúde humana e animal e que tenha elevado risco de disseminação e de causar efeitos adversos à flora, ao meio ambiente e à comunidade;
XXII - Parecer consubstanciado: parecer de apreciação ética de um protocolo de pesquisa, emitido após a tramitação simplificada, colegiada ou colegiada especial;
XXIII - Parecer sumário: parecer decorrente da submissão de protocolo de pesquisa, avaliado via tramitação expressa no Sistema CEP/Conep;
XXIV - Pesquisa-ação: pesquisa em que todas as etapas são planejadas e executadas com os diferentes atores envolvidos de comum acordo;
XV - Pesquisa de mercado: coleta de informações junto ao consumidor, ao concorrente ou ao fornecedor, para orientar a tomada de decisões ou solucionar problemas de ordem mercadológica;
XVI - Pesquisa de opinião pública: consulta verbal ou escrita de caráter pontual, realizada por meio de metodologia específica, através da qual o participante é convidado a expressar sua preferência, avaliação ou o sentido que atribui a temas, atuação de pessoas e organizações, ou a produtos e serviços; sem possibilidade de identificação do participante;
XVII - Pesquisa de interesse estratégico para o SUS: protocolos que contribuam para a saúde pública, a justiça, a redução das desigualdades sociais e das dependências tecnológicas, bem como emergências em saúde pública, encaminhados à apreciação da Conep mediante solicitação da Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde, do Ministério da Saúde (SCTIE/MS);
XVIII - Pesquisa encoberta: pesquisa conduzida sem que o participante seja informado sobre os objetivos e procedimentos do estudo, e sem que o consentimento seja obtido previamente ou durante a realização da pesquisa. A pesquisa encoberta somente se justifica em circunstâncias nas quais a informação sobre objetivos e procedimentos alteraria o comportamento-alvo do estudo, ou quando a utilização deste método se apresenta como única forma de condução do estudo, devendo ser explicitado ao CEP o procedimento a ser adotado pelo pesquisador com o participante, no que se refere a riscos, comunicação ao participante e uso dos dados coletados, além do compromisso, ou não, com a confidencialidade. Sempre que se mostre factível, o consentimento do participante deverá ser buscado posteriormente;
XIX - Privacidade: direito do participante da pesquisa de manter o controle sobre suas escolhas e informações pessoais e de resguardar sua intimidade, sua imagem e seus dados pessoais, sendo uma garantia de que essas escolhas de vida não sofrerão invasões indevidas, pelo controle público, estatal ou não estatal, e pela reprovação social, a partir das características ou dos resultados da pesquisa;
XXX - Procedimento da pesquisa: processo realizado especificamente em virtude do estudo, previamente delineado nos métodos da pesquisa fundamentada em suas bases epistemológicas, envolvendo a apresentação adequada e justificada das técnicas e dos instrumentos operativos que devem ser utilizados para alcançar os objetivos definidos. O procedimento pode envolver, ou não, intervenção no corpo humano e ter, ou não, caráter invasivo;
XXXI - Procedimento invasivo na dimensão física: procedimento da pesquisa que atravessa as barreiras naturais físicas do corpo humano, com ou sem descontinuidade delas, ou adentra suas cavidades por meio de orifícios naturais;
XXXII - Produto biológico: corresponde a um medicamento biológico (alérgenos, anticorpos, biomedicamentos, hemoderivados, probióticos e vacinas), um produto de terapia avançada (terapia celular, terapia genética e terapia de engenharia tecidual) e afins;
XXXIII - Protagonismo: direito do participante de assumir um papel ativo no processo de produção do conhecimento, não de informante, nem de interlocutor da pesquisa, podendo identificar-se, se assim desejar, e, inclusive, fazer constar sua coautoria, se esse for o caso;
XXXIV - Registro do consentimento ou do assentimento: documento produzido em qualquer meio, formato ou mídia, como papel, áudio, filmagem, mídia eletrônica e digital, que registre a concessão de consentimento ou de assentimento livre e esclarecido, sendo a forma de registro escolhida a partir das características individuais, sociais, linguísticas, econômicas e culturais do participante da pesquisa e em razão das abordagens metodológicas aplicadas;
XXXV - Termo de consentimento livre e esclarecido: documento no qual é explicitado o consentimento livre e esclarecido do participante e/ou de seu responsável legal, de forma escrita, devendo conter todas as informações necessárias, em linguagem clara e objetiva, de fácil entendimento, para o mais completo esclarecimento sobre a pesquisa da qual se propõe participar;
XXXVI - Termo de assentimento: documento elaborado em linguagem acessível para os menores ou para os legalmente incapazes, por meio do qual, após os participantes da pesquisa serem devidamente esclarecidos, explicitarão sua anuência em participar da pesquisa, sem prejuízo do consentimento de seus responsáveis legais;
XXXVII - Tipificação da pesquisa: processo pelo qual se define o tipo da pesquisa, baseando-se no delineamento do estudo e nos procedimentos da pesquisa;
XXXVIII - Tramitação ad referendum: tramitação do protocolo, no Sistema CEP/Conep, que dispensa deliberação do colegiado, devendo, no entanto, ser o parecer registrado e comunicado na reunião seguinte do CEP e/ou da Conep;
XXXIX - Tramitação de protocolo: refere-se à forma e às etapas pelas quais o protocolo de pesquisa é processado no Sistema CEP/Conep.
Capítulo III
DO DELINEAMENTO DO ESTUDO
Art. 3° As pesquisas envolvendo seres humanos podem ser tipificadas segundo o delineamento do estudo, dividindo-se em dois tipos, de acordo com os seus objetivos:
I - Estudos que visam descrever ou compreender fenômenos que aconteceram ou acontecem no cotidiano do participante de pesquisa;
II - Estudos que visam verificar o efeito de produto ou técnica em investigação, deliberadamente aplicado no participante em virtude da pesquisa, de forma prospectiva, com grupo-controle ou não.
Capítulo IV
DO PROCEDIMENTO DA PESQUISA
Art. 4° As pesquisas envolvendo seres humanos podem ser tipificadas segundo o seu procedimento, dividindo-se em dois tipos:
I - Estudos que envolvem intervenção no corpo humano;
II - Estudos que não envolvem intervenção no corpo humano.
Art. 5° O procedimento da pesquisa que envolve intervenção no corpo humano pode ter, ou não, caráter invasivo na dimensão física.
Capítulo V
DA TIPIFICAÇÃO DA PESQUISA
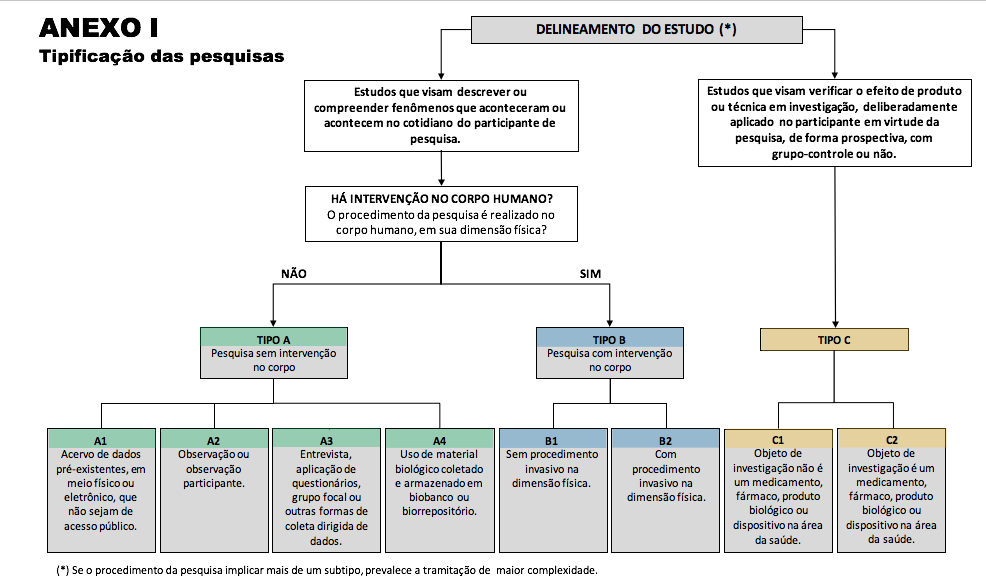
Art. 6° As pesquisas são classificadas, segundo o delineamento e o procedimento do estudo, em três tipos: A, B e C, conforme disposto no Anexo I desta Resolução.
Art. 7° As pesquisas tipo A visam descrever ou compreender fenômenos que aconteceram ou acontecem no cotidiano, não havendo intervenção no corpo humano. Dividem-se nos subtipos:
I - A1: quando realizada exclusivamente a partir de acervo de dados pré-existentes, em meio físico ou eletrônico, que não sejam de acesso público;
II - A2: quando realizada com observação ou observação participante;
III - A3: quando realizada entrevista, aplicação de questionários, grupo focal ou outras formas de coleta dirigida de dados (presencial ou não-presencial/virtual/eletrônica/telefônica);
IV - A4: quando realizada com material biológico armazenado em biobanco ou biorrepositório, ou exclusivamente com culturas de células humanas já estabelecidas.
Art. 8° As pesquisas tipo B visam descrever ou compreender fenômenos que acontecem no cotidiano, havendo intervenção física no corpo humano. Dividem-se nos subtipos:
I - B1: quando nenhum dos procedimentos da pesquisa tem caráter invasivo na dimensão física;
II - B2: quando algum dos procedimentos da pesquisa tem caráter invasivo na dimensão física.
Art. 9° As pesquisas tipo C visam verificar o efeito de produto ou técnica em investigação, deliberadamente aplicado no participante em virtude da pesquisa, de forma prospectiva, com grupo-controle ou não. Dividem-se nos subtipos:
I - C1: quando o objeto de investigação não é um medicamento, fármaco, produto biológico ou dispositivo da área da saúde;
II - C2: quando o objeto de investigação é um medicamento, fármaco, produto biológico ou dispositivo da área da saúde.
Capítulo VI
DOS FATORES DE MODULAÇÃO
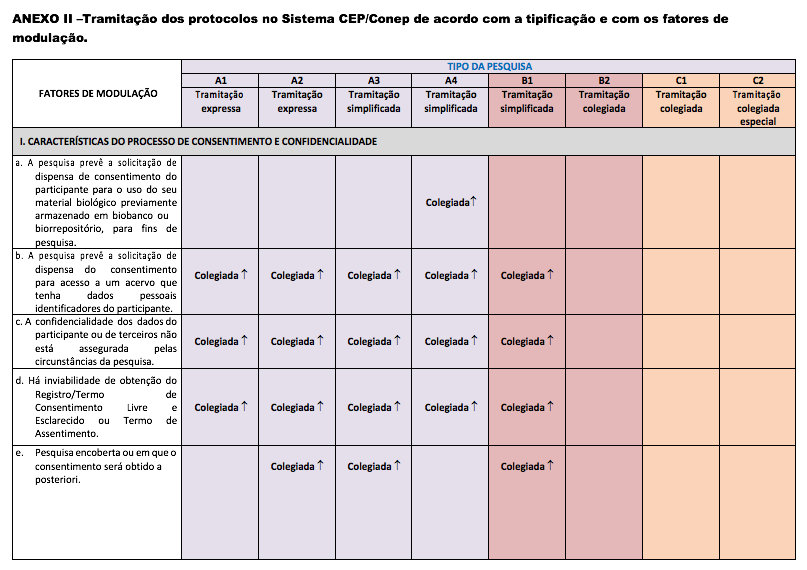
Art. 10 Os fatores de modulação modificam a forma de tramitação do protocolo de pesquisa, conforme disposto no Anexo II desta Resolução. São definidos de acordo com:
I - Características do processo de consentimento e confidencialidade:
- a) a pesquisa prevê a solicitação de dispensa de consentimento do participante para o uso do seu material biológico previamente armazenado em biobanco ou biorrepositório;
- b) a pesquisa prevê a solicitação de dispensa do consentimento para acesso a um acervo que tenha dados pessoais identificadores do participante;
- c) a confidencialidade dos dados do participante ou de terceiros não está assegurada pelas circunstâncias da pesquisa;
- d) há inviabilidade para obtenção do Registro/Termo de Consentimento Livre e Esclarecido ou Termo de Assentimento;
- e) pesquisa encoberta ou em que o consentimento será obtido a posteriori;
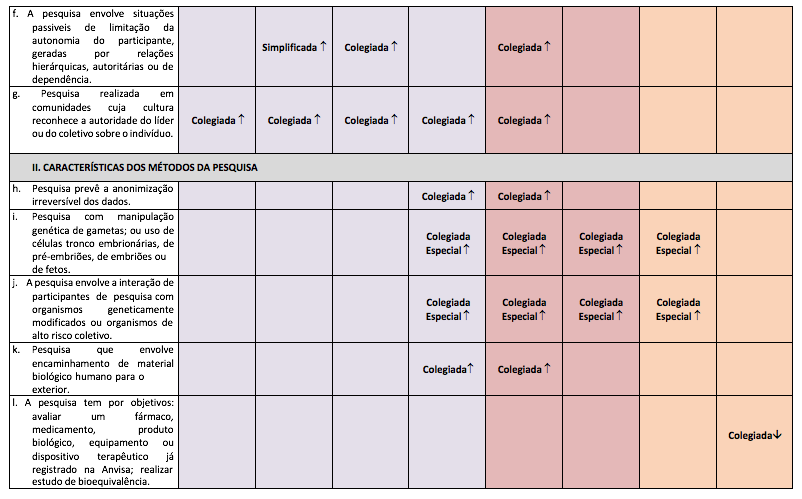
- f) a pesquisa envolve situações passiveis de limitação da autonomia do participante, geradas por relações hierárquicas, de autoridade ou de dependência;
- g) pesquisa realizada em comunidades cuja cultura reconheça a autoridade do líder ou do coletivo sobre o indivíduo.
II - Características dos métodos da pesquisa:
- a) a pesquisa prevê a anonimização irreversível dos dados;
- b) pesquisa com manipulação genética de gametas ou uso de células tronco embrionárias, de pré-embriões, de embriões ou de fetos;
- c) a pesquisa envolve a interação de participantes de pesquisa ou da comunidade com organismos geneticamente modificados ou organismos de alto risco coletivo;
- d) pesquisa que envolve encaminhamento de material biológico humano para o exterior;
- e) a pesquisa tem por objetivo: avaliar um fármaco, medicamento, produto biológico, equipamento ou dispositivo terapêutico já registrado na Anvisa; realizar estudo de bioequivalência;
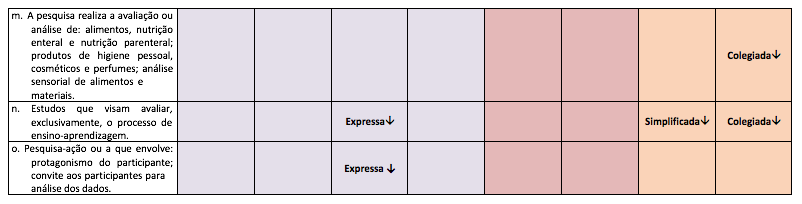
- f) a pesquisa realiza a avaliação ou análise de alimentos, nutrição enteral e nutrição parenteral; produtos de higiene pessoal, cosméticos e perfumes; análise sensorial de alimentos e materiais;
- g) estudos que visam avaliar, exclusivamente, o processo de ensino-aprendizagem;
- h) pesquisa-ação ou a que envolva: protagonismo do participante; convite aos participantes para a análise dos dados.
Art. 11 Os fatores de modulação não modificam o tipo da pesquisa, mas a modalidade de tramitação do protocolo.
Art. 12 As características do participante de pesquisa, em si, não constituem fator de modulação.
Capítulo VII
DA TRAMITAÇÃO DOS PROTOCOLOS
Art. 13 Há quatro modalidades de tramitação dos protocolos no Sistema CEP/Conep: expressa, simplificada, colegiada e colegiada especial.
- §1° As tramitações previstas para os tipos de protocolos de pesquisa são:
- a) tramitação expressa: tipos A1 e A2;
- b) tramitação simplificada: tipos A3, A4 e B1;
- c) tramitação colegiada: tipos B2 e C1;
- d) tramitação colegiada especial: tipo C2.
- §2° Os fatores de modulação podem alterar essa tramitação, conforme o Anexo II desta Resolução.
- §3° Por iniciativa do relator ou do coordenador do CEP, mediante justificativa, o protocolo pode ter a sua modalidade de tramitação modificada, condizente com o tipo de pesquisa e com os fatores de modulação aplicáveis.
Art. 14 A tramitação expressa prevê a emissão de Parecer Sumário e, nas demais modalidades, Parecer Consubstanciado.
- §1° Os pareceres são emitidos ao pesquisador pelo coordenador do CEP.
- §2° Os pareceres sumário e consubstanciado seguem formulários estabelecidos na Plataforma Brasil.
Art. 15 Na tramitação expressa, a análise ética é fundamentada, sobretudo, na checagem, pelo relator, do tipo de pesquisa, dos fatores de modulação preenchidos pelo pesquisador na Plataforma Brasil e dos documentos apresentados.
- §1° O relator deve aprovar o protocolo, quando este atender a todas as seguintes condições:
- a) ser pesquisa tipo A1 ou A2;
- b) não houver fator de modulação que altere a tramitação (Anexo II).
- c) não houver óbices éticos.
- §2° No caso de aprovação do protocolo pelo relator, o parecer é encaminhado ao coordenador para emissão do Parecer Sumário. A análise pelo colegiado é dispensada, devendo a deliberação ser registrada e comunicada na reunião seguinte do colegiado.
- §3° Caso sejam identificados óbices éticos, o protocolo deverá tramitar na modalidade simplificada ou colegiada, conforme a indicação do relator.
Art. 16 Na tramitação simplificada, a análise ética é fundamentada, sobretudo, na checagem, pelo relator, do tipo de pesquisa, dos fatores de modulação preenchidos pelo pesquisador na Plataforma Brasil e dos documentos apresentados.
- §1° O relator, após apreciação ética, deve aprovar o protocolo, quando este atender a todas as seguintes condições:
- a) ser pesquisa tipo A3, A4 e B1;
- b) não houver fator de modulação que altere a tramitação (Anexo II);
- c) não houver óbices éticos.
- §2° No caso de aprovação do protocolo pelo relator, o parecer é encaminhado ao coordenador para emissão do Parecer Consubstanciado. A análise pelo colegiado é dispensada, devendo a deliberação ser registrada e comunicada na reunião seguinte do colegiado.
- §3° Caso haja pendências éticas que não permitam a aprovação prevista no parágrafo 1°, a apreciação do parecer do relator, pelo colegiado, será necessária quando:
I - Parecer inicial for de não aprovação;
II - Parecer de resposta de pendência for de não aprovação;
III - Análise de recurso.
- §4° Nas demais situações de análise de pendências, a tramitação ad referendum é possível. Neste caso, a deliberação deve ser comunicada na reunião seguinte do colegiado.
Art. 17 Na tramitação colegiada, a análise ética é fundamentada, sobretudo, na checagem do tipo de pesquisa, dos fatores de modulação preenchidos pelo pesquisador na Plataforma Brasil, dos documentos apresentados e da apreciação do colegiado do CEP.
- §1° O relator, após apreciação ética, deve aprovar o protocolo, quando este atender a todas as seguintes condições:
- a) ser pesquisa tipo B2 e C1;
- b) não houver fator de modulação que altere a tramitação (Anexo II);
- c) não houver óbices éticos.
- §2° No caso de aprovação do projeto pelo relator, a apreciação do parecer deverá ser realizada pelo colegiado antes da emissão do Parecer consubstanciado pelo coordenador, nos casos de:
I - Análise inicial de protocolo ou de emenda, independentemente do parecer;
II - Análise inicial de notificação com parecer de não aprovação;
III - Análise de resposta com parecer de pendência ou de não aprovação;
IV - Análise de recurso.
- §3° Nos casos de análise de respostas com parecer de aprovação, a tramitação ad referendum é possível. Neste caso, a deliberação deve ser comunicada na reunião seguinte do colegiado.
Art. 18 Na tramitação colegiada especial, a análise ética é fundamentada, sobretudo, na checagem do tipo de pesquisa, dos fatores de modulação preenchidos pelo pesquisador na Plataforma Brasil, dos documentos apresentados e na apreciação pelo colegiado do CEP acreditado ou da Conep.
- §1° O relator, após apreciação ética, deve aprovar o protocolo, quando este atender a todas as seguintes condições:
- a) ser pesquisa tipo C2;
- b) não houver fator de modulação que altere a tramitação (Anexo II);
- c) não houver óbices éticos.
- §2° No caso de aprovação do protocolo pelo relator, a apreciação do parecer deverá ser realizada pelo colegiado do CEP acreditado antes da emissão do Parecer Consubstanciado pelo coordenador, nos casos de:
I - Análise inicial de protocolo ou de emenda, independentemente do parecer;
II - Análise inicial de notificação com parecer de não aprovação;
III - Análise de resposta com parecer de pendência ou de não aprovação;
IV - Análise de recurso.
- §3° Nos casos de análise de respostas com parecer de aprovação, a tramitação ad referendum é possível. Neste caso, a deliberação deve ser comunicada na reunião seguinte do colegiado.
- §4° A tramitação colegiada especial segue o rito previsto no Capítulo VII da Resolução CNS n° 506, de 3 de fevereiro de 2016.
Art. 19 Em caso de dúvidas acerca da tipificação da pesquisa ou dos fatores de modulação associados, o coordenador do CEP deve encaminhar o parecer do relator para apreciação do colegiado.
Art. 20 No caso de estudo multicêntrico, a tramitação inicial ocorre no CEP do centro coordenador ou CEP acreditado, quando for o caso, sendo posteriormente encaminhado para análise dos CEP dos demais centros e/ou instituições coparticipantes, após aprovação.
Capítulo VIII
DOS PRAZOS DE TRAMITAÇÃO DOS PROTOCOLOS
Art. 21 O prazo para checagem documental é de até 7 (sete) dias.
Art. 22 O prazo para emissão do parecer, após a checagem documental, é de até 15 (quinze) dias para a tramitação expressa; até 21 (vinte e um) dias para a tramitação simplificada; até 30 (trinta) dias para a tramitação colegiada; e até 45 (quarenta e cinco) dias para a tramitação colegiada especial.
Parágrafo único. Caso haja alteração na forma de tramitação, por avaliação do CEP, a contagem do prazo será iniciada com a nova modalidade de tramitação.
Art. 23 O pesquisador tem prazo de até 30 (trinta) dias, prorrogáveis mediante justificativa, para responder a um parecer de pendência do CEP, na Plataforma Brasil.
Art. 24 A primeira instância recursal é o CEP no qual houver a não aprovação do protocolo de pesquisa, sendo a Conep a próxima e última instância de recurso no Sistema CEP/Conep.
Parágrafo único. O prazo de solicitação do recurso é de até 30 (trinta) dias para cada instância.
Art. 25 A submissão, pelo pesquisador, de resposta a um parecer de pendência ou de recurso a um parecer de não aprovação reinicia a contagem dos prazos de tramitação.
Capítulo IX
DAS PESQUISAS DISPENSADAS DE REGISTRO NA PLATAFORMA BRASIL
Art. 26 São dispensadas de apreciação, pelo Sistema CEP/Conep, as pesquisas que se enquadrem exclusivamente nas seguintes situações:
I - Pesquisa de opinião pública com participantes não identificáveis;
II - Pesquisa que utilize informações de acesso público, nos termos da Lei n° 12.527, de 18 de novembro de 2011;
III - Pesquisa que utilize informações de domínio público;
IV - Pesquisa censitária realizada por órgãos do governo;
V - Pesquisa realizada exclusivamente com informações ou dados já disponibilizados de forma agregada, sem possibilidade de identificação individual;
VI - Pesquisa realizada exclusivamente com textos científicos para revisão da literatura científica;
VII - Pesquisa que objetiva o aprofundamento teórico de situações que emergem espontânea e contingencialmente na prática profissional, desde que não revelem dados que possam identificar o indivíduo;
VIII - Atividade realizada com o intuito exclusivamente de educação, ensino, extensão ou treinamento, sem finalidade de pesquisa científica, de alunos de graduação, de curso técnico, ou de profissionais em especialização.
- a) não se enquadram no inciso antecedente os Trabalhos de Conclusão de Curso de Graduação, Dissertações de Mestrado, Teses de Doutorado, Monografias e similares, devendo-se, nesses casos, apresentar o protocolo de pesquisa ao Sistema CEP/Conep;
- b) caso, durante o planejamento ou a execução da atividade de educação, ensino, extensão ou treinamento surja a intenção de incorporação dos resultados dessas atividades em um projeto de pesquisa, dever-se-á, de forma obrigatória, apresentar o protocolo de pesquisa ao Sistema CEP/Conep.
IX - Pesquisas de mercado;
X - Pesquisas científicas realizadas com células, tecidos, órgãos e organismos de origem não humana, incluindo seus produtos biológicos, desde que não haja interação com participantes de pesquisa ou impliquem a coleta ou o uso de material biológico humano para obtenção deles;
XI - Atividade cuja finalidade seja descrever ou analisar o processo produtivo ou administrativo para fins, exclusivamente, de desenvolvimento organizacional.
Capítulo X
DAS DISPOSIÇÕES FINAIS
Art. 27 As pesquisas consideradas de interesse estratégico para o SUS serão encaminhadas para apreciação na Conep e terão tramitação especial em até 10 (dez) dias.
Art. 28 Nas pesquisas nas quais o Ministério da Saúde é a instituição proponente, a Conep será o CEP responsável pela análise, devendo-se seguir a tipificação da pesquisa e a modalidade de tramitação nos termos desta Resolução.
Art. 29 O registro dos protocolos de desenvolvimento de biobanco é atribuição exclusiva da Conep, não sendo aplicável o conceito de tipificação da pesquisa e de fatores de modulação.
Art. 30 Na Resolução CNS n° 466, de 12 de dezembro de 2012, Resolução CNS n° 506, de 3 de fevereiro de 2016, e Resolução CNS n° 510, de 7 de abril de 2016, onde se lê “definição e gradação de risco”, entenda-se como “tipificação da pesquisa”; onde se lê “níveis de risco” ou “risco mínimo, baixo, moderado ou elevado”, entenda-se como “tipificação da pesquisa e modalidade de tramitação”, nos termos desta Resolução.
Art. 31 Ficam sem efeito os prazos de tramitação definidos nos itens 2.2 e 2.3 da Norma Operacional CNS n° 001, de 30 de setembro de 2013.
Art. 32 Protocolos de pesquisa das áreas temáticas previstas no item IX.4, subitens de 1 a 8 da Resolução CNS n° 466, de 12 de dezembro de 2012, devem seguir a tipificação da pesquisa e a modalidade de tramitação, nos termos desta Resolução.
Parágrafo único. O CEP poderá encaminhar para apreciação da Conep, a seu critério, protocolo de pesquisa com a devida justificativa.
Art. 33 Esta Resolução entrará em vigor quando da implementação de adequações da Plataforma Brasil para sua operacionalização.
FERNANDO ZASSO PIGATTO
Presidente do Conselho Nacional de Saúde
Homologo a Resolução CNS nº 674, de 06 de maio de 2022, nos termos da Lei nº 8.142, de 28 de dezembro de 1990.
MARCELO ANTÔNIO CARTAXO QUEIROGA LOPES
Ministro de Estado da Saúde



Redes Sociais